OBP-301 (Telomelysin)是經過基因修飾的第5型腺病毒(Adenovirus)的溶瘤病毒治療藥物,主要針對癌細胞作用而不傷及正常細胞,因此它可以選擇性地在癌細胞內複製,造成癌細胞的溶解,進而達到殺死癌細胞的目的。OBP-301 已分別於2020年4月取得美國FDA食道癌孤兒藥資格認定,並於2025年12月獲日本厚生勞動省指定,用於治療不適合根治性切除及化學治療之食道癌患者,為罕見疾病再生醫療製品(即孤兒藥指定)。
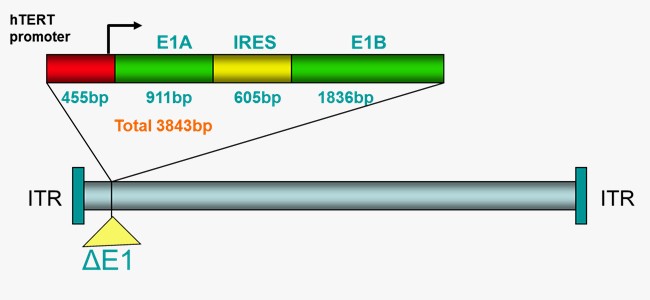
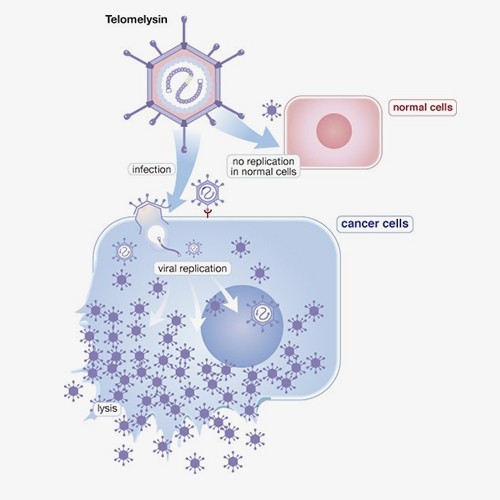
OBP-301是由日本上市公司Oncolys生技製藥公司(Oncolys BioPharma Inc.) 及基亞公司共同研發製造。