OBP-301 (Telomelysin)是经过基因修饰的第5型腺病毒(Adenovirus)的溶瘤病毒治疗药物,主要针对癌细胞作用而不伤及正常细胞,因此它可以选择性地在癌细胞内复制,造成癌细胞的溶解,进而达到杀死癌细胞的目的。OBP-301 已分别于2020年4月取得美国FDA食道癌孤儿药资格认定,并于2025年12月获日本厚生劳动省指定,用于治疗不适合根治性切除及化学治疗之食道癌患者,为罕见疾病再生医疗制品(即孤儿药指定)。
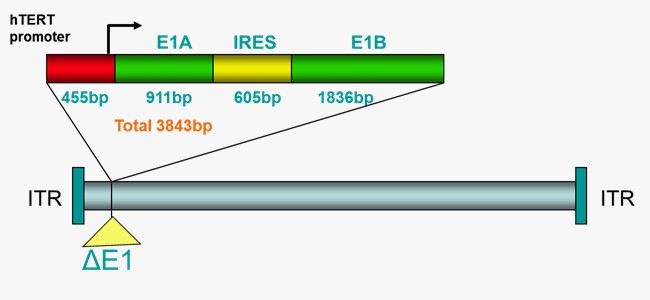
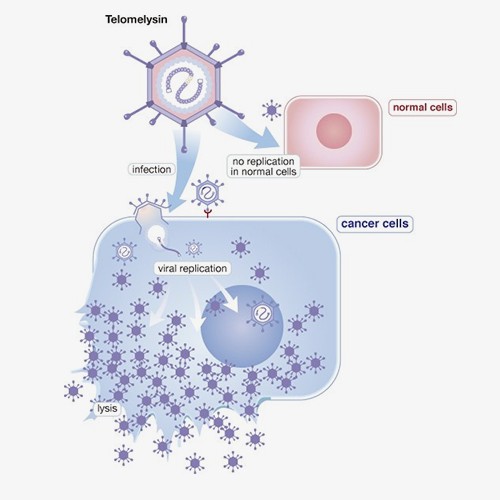
OBP-301是由日本上市公司Oncolys生技制药公司(Oncolys BioPharma Inc.) 及基亚公司共同研发制造。