
自然殺手細胞(Natural Killer Cells, NK細胞)是一群具備CD3-CD56+表現型的免疫細胞,通常存在於淋巴結、各器官及周邊血液中。NK細胞在人體周邊血液淋巴球中約佔5~20%,因此周邊血液是取得NK細胞合適的來源之一。但直接取自於周邊血液之 NK細胞,由於數量和活性皆不足,所以通常會藉由體外擴增 (Ex Vivo Expansion)之方式來增加NK細胞之數量及活性後再用於治療。
NK細胞源自於造血幹細胞(CD34+ Stem Cells),與T細胞和B細胞源自於相同之淋巴先驅細胞(Lymphoid Progenitor Cells),但它們不具備T細胞之特徵(CD3及T Cell Receptor)或B細胞之特徵(CD19及CD20),是屬於先天性免疫(Innate Immunity)的一個重要成員(1-3)。它們在1970年代被發現具有毒殺癌細胞之特性,且事先不需要經過教育或致敏(Priming)的過程,因此遂有自然殺手細胞之名稱。後續研究發現,NK細胞除了可以毒殺癌細胞之外,還可以殺死被病毒感染之細胞、癌化之細胞及老化或受壓力之細胞(Stressed Cells)(4)。
在一個為期11年包含了3,600多人的公衛研究報告指出,NK細胞毒殺活性的高低與罹患癌症的風險成負相關,且此現象男、女皆然。腫瘤浸潤性NK細胞的存在,已被視為是多種惡性腫瘤的正向預後指標之一,包含大腸直腸癌、胃癌和鱗狀細胞肺癌(5-7)。過去的研究已顯示NK細胞具有治療實體腫瘤之潛力;而最近多項研究的結果顯示,NK細胞也可用於治療血液惡性腫瘤,包括急性骨髓性白血病(Acute Myeloid Leukemia, AML) (8-9)和多發性骨髓瘤(Multiple Myeloma) (10-11)等。
NK細胞可以藉由下列機制殺死癌細胞(1-3):(i)分泌穿孔素(Perforin)及顆粒酶(Granzyme)誘發癌細胞凋亡(Apoptosis)。(ii)藉由細胞表面表現死亡配體(Death Ligand)與癌細胞表面之死亡受器(Death Receptor)結合,進而驅動癌細胞之凋亡。(iii)可藉由分泌TNF-α與IFN-γ等細胞激素來調控其他免疫細胞的功能,如T細胞及樹突狀細胞,進而強化抗癌能力。(iv)若有抗體與癌細胞表面抗原結合時,NK細胞可藉由其表面之Fc受器(CD16)和抗體分子之Fc部位結合而靠近癌細胞,進而毒殺癌細胞,此現象又稱為抗體依賴性細胞毒殺(Antibody-dependent Cell-mediated Cytotoxicity, ADCC)。
基亞生技依據數年免疫細胞體外擴增研發,發展出自有的自然殺手細胞培養技術,而依此技術培養出的自然殺手細胞是為 “Magicell-NK”,具有數量多、高純度與高毒殺活性,並且無使用任何非人體來源的成份和餵養細胞 (feeder cells)。
Magicell®-NK在經14 ± 2天體外擴增後,其特徵為具有CD3-CD56+之NK細胞。在多次擴增Magicell®-NK分析中,表現型CD3-CD56+ 之NK細胞占組成大於 95%,為高純度NK細胞。整體細胞存活率大於 98%。
進一步測試 Magicell-NK 的癌細胞毒殺能力,亦有高達 90%的毒殺率 (圖 1)
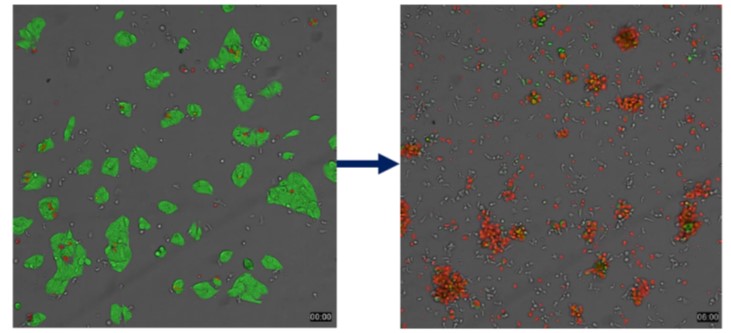
圖1. Magicell-NK具有高度細胞毒殺能力。
(註: 左圖綠色顯示毒殺作用前活的肝癌細胞 (HepG2); 右圖紅色顯示已被 Magicell-NK毒殺作用後死亡的肝癌細胞。其中較小無色點狀是為 Magicell-NK)
參考文獻:
- Chiossone, L., et al., Natural killer cells and other innate lymphoid cells in cancer. Nat Rev Immunol, 2018. 18(11): p. 671-688.
- Geiger, T.L. and J.C. Sun, Development and maturation of natural killer cells. Curr Opin Immunol, 2016. 39: p. 82-89.
- Abel, A.M., et al., Natural Killer Cells: Development, Maturation, and Clinical Utilization. Front Immunol, 2018. 9: p. 1869.
- Chan, C.J., M.J. Smyth, and L. Martinet, Molecular mechanisms of natural killer cell activation in response to cellular stress. Cell Death Differ, 2014. 21(1): p. 5-14.
- Villegas, F.R., et al., Prognostic significance of tumor infiltrating natural killer cells subset CD57 in patients with squamous cell lung cancer. Lung Cancer, 2002. 35(1): p. 23-28.
- Versluis, M.A.C., et al., The prognostic benefit of tumour-infiltrating Natural Killer cells in endometrial cancer is dependent on concurrent overexpression of Human Leucocyte Antigen-E in the tumour microenvironment. Eur J Cancer, 2017. 86: p. 285-295.
- Stangl, S., et al., Heat shock protein 70 and tumor-infiltrating NK cells as prognostic indicators for patients with squamous cell carcinoma of the head and neck after radiochemotherapy: A multicentre retrospective study of the German Cancer Consortium Radiation Oncology Group (DKTK-ROG). Int J Cancer, 2018. 142(9): p. 1911-1925.
- Przespolewski, A., A. Szeles, and E.S. Wang, Advances in immunotherapy for acute myeloid leukemia. Future Oncol, 2018. 14(10): p. 963-978.
- Parisi, S., et al., The More, The Better: “Do the Right Thing” For Natural Killer Immunotherapy in Acute Myeloid Leukemia. Front Immunol, 2017. 8: p. 1330.
- Pittari, G., et al., Restoring Natural Killer Cell Immunity against Multiple Myeloma in the Era of New Drugs. Front Immunol, 2017. 8: p. 1444.
- Fionda, C., et al., Translating the anti-myeloma activity of Natural Killer cells into clinical application. Cancer Treat Rev, 2018. 70: p. 255-264.

